
Chapitre 4 : qualité des aliments
Je prends connaissance des objectifs du chapitre.
-
Mettre en œuvre un protocole pour mettre en évidence l'oxydation des aliments.
-
Distinguer une transformation physique d'une réaction chimique.
-
Associer un changement d'état à un processus de conservation.
-
Extraire et organiser des informations pour rendre compte de l'évolution des modes de conservation des aliments et analyser la formulation d'un produit alimentaire.
-
Interpréter le rôle d'une espèce tensioactive dans la stabilisation d'une émulsion.
Votre contribution...
Je consulte le cours (et je l'apprends !)

Pourquoi les aliments s'altèrent-ils à l'air libre ?
Lorsqu'ils sont exposés à l'air libre, certains aliments se dégradent, leur conférant alors un goût, une odeur et un aspect peu appréciables : ils se sont oxydés. L'oxydation est une réaction chimique entre le dioxygène de l'air et certaines molécules présentes dans les aliments.
Dans le cas des fruits et des légumes, le dioxygène de l'air réagit avec des molécules de polyphénol, grâce à des enzymes contenues dans l'aliment. Les molécules de polyphénol se transforment alors en molécules de quinone puis en molécules de pigments bruns. On parle de brunissement enzymatique.
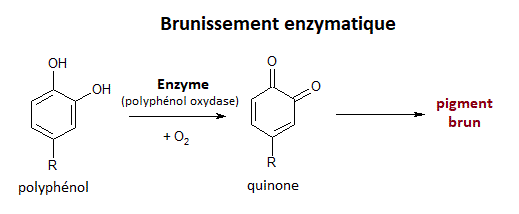
Dans les cas des lipides, c'est-à-dire des matières grasses, ce sont les acides gras insaturés (comportant une double liaison carbone-carbone) qui vont s'oxyder.
Sous l'action de la lumière (rayon UV) ces molécules se scindent en deux parties. Les deux molécules ainsi formées sont appelées radicaux libres : ce sont des molécules très instables. Elles réagissent très facilement avec le dioxygène de l’air pour donner des molécules stables et de nouveaux radicaux libres, induisant ainsi une réaction en chaîne, responsable du rancissement de l'aliment. Cela se traduit par une modification de la couleur et du goût, accompagnée d'une odeur désagréable et de la formation de substances nocives.
Cette réaction ne peut se faire qu'en présence de dioxygène et est favorisée par différents facteurs tels que la chaleur ou l'exposition à la lumière. C'est donc sur ces éléments que l'on peut agir pour réduire, voir stopper la réaction d'oxydation.
Comment conserver des aliments par des méthodes physiques ?
Pour éviter la dégradation des aliments, on peut les mettre à l'abri de l'air et de l'eau (sous vide ou sous atmosphère protectrice), de la lumière (emballage opaque) ou les refroidir (réfrigération
D'autres techniques de conservation font intervenir des changements d'état, autrement dit des transformations physiques :
-
La lyophilisation : l'aliment est d'abord congelé pour solidifier l'eau, puis il est placé sous vide afin de sublimer l'eau c'est-à-dire de la faire passer directement de l'état solide à l'état gazeux. Cela revient à faire un séchage à froid. Cette technique est par exemple utilisée pour fabriquer le café soluble.
-
la congélation : la température est abaissée et maintenue à -18°C, provoquant la solidification de l'eau contenue dans les aliments.
-
La surgélation : le principe est le même que pour la congélation mais le refroidissement est plus rapide et la température plus basse. Les produits surgelés ont une durée de conservation supérieure à celle des produits congelés, et leurs propriétés (texture, goût…) sont mieux préservées.



Comment conserver des aliments par des méthodes chimiques ?
L'oxydation des aliments peut être ralentie par l'adjonction d'antioxydants, qui peuvent être d'origine naturelle (vitamine A, C et E…) ou artificielle (ascorbate de sodium par exemple). Ils vont diminuer ou empêcher la formation des radicaux libres ou bien réagir avec ces derniers pour former des composés plus stables. Dans les fruits, ils vont s'oxyder à la place des polyphénols.
Ces anti-oxydants font partie des additifs alimentaires dont l'utilisation est réglementé par une directive européenne.
Comment monter une mayonnaise ? (ou mieux, réaliser une ganache au chocolat !)

A l’œil nu, la mayonnaise est un mélange homogène. En réalité, elle est constituée de minuscules gouttelettes d'huile dispersées dans une solution aqueuse, formée par le jaune d’œuf. On appelle cela une émulsion d'huile dans l'eau.
Pourtant l'huile et l'eau ne sont pas miscibles et forment normalement deux phases (couches) distinctes. C'est grâce à la présence d'un autre type de molécules, appelé tensio-actif ou émulsifiant, que les gouttelettes vont rester en suspension dans l'eau pour former une émulsion stable. Dans la mayonnaise, c'est le jaune d’œuf et la moutarde qui apportent ces composés tensio-actifs, sous forme de protéines et de lécithines.



Les molécules tensio-actives ont une structure particulière. Elles possèdent une partie hydrophile, attirée par l'eau, et une partie hydrophobe qui ne peut se lier avec l'eau, mais qui présente une affinité avec les lipides : elle est lipophile.
Un tensioactif peut donc se lier à la fois à l'eau et aux lipides et créer un lien entre les deux.

En battant, donc en frictionnant la mayonnaise, de fines gouttelettes d'huile se dispersent dans la phase aqueuse et les agents tensio-actifs se placent tout autour de ces gouttelettes, la partie hydrophobe se plaçant dans la gouttelette d'huile et la partie hydrophile dans l'eau. Il se forme alors des micelles qui stabilisent l'émulsion.

Dans le cas d'une ganache au chocolat, c'est la phase aqueuse (la crème ou le lait) qui est rajoutée progressivement dans la matière grasse (le beurre de cacao contenu dans le chocolat). Il se forme alors une émulsion d'eau dans la matière grasse : ce sont des gouttelettes d'eau en suspension dans la phase grasse.

